Fizikte rota değişimine neden olan Heisenberg'in Belirsizlik İlkesi
Alman fizikçi Karl Werner Heisenberg atomun yapısı ile ilgili konuya katkılarından dolayı 1932 yılında fizik dalında Nobel Ödülü'nü aldı ve 1927’de kendi ismiyle anılan Belirsizlik İlkesi'ni buldu.
1920'lerde Heisenberg, atomaltı taneciklerin davranışlarının ne dereceye kadar belirlenebileceğini görebilmek için hipotetik deneyler tasarladı. Bunun için taneciğin konumu ve momentumu gibi iki değişkenin ölçülmesi gerekliydi.
Temelde kuantum parçacıkları aynı anda hem dalga hem parçacıktır. Fakat ölçmeye veya gözlemlemeye kalkarsanız ya dalgayı ya da parçacığı bulursunuz. İkisi aynı anda saptanamazlar. İşte Heisenberg’in Belirsizlik İlkesi’nin temeli de tam olarak budur.
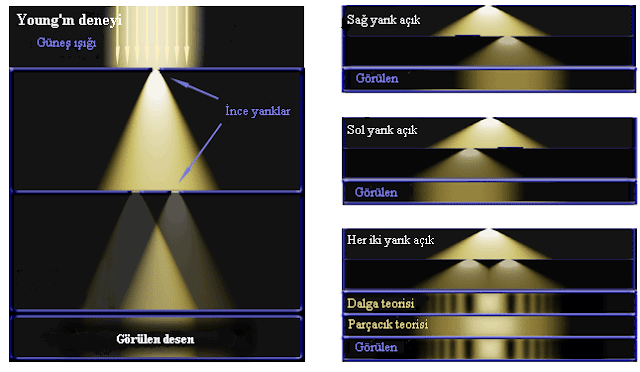
Çift Yarık Deneyi (detaylı bilgileri daha sonra paylaşıcam)
Eğer elektron parçacıksa onun kesin konumunu, dalgaysa momentumunu (hızını) ölçebiliriz.
Günlük yaşamda hareket halinde olan nesnelerin yerini ve momentumlarını saptamak bir sorun oluşturmaz. Örneğin bilardo topunun bilardo masasının neresinde olduğunu, hızını ve yönünü aynı anda kolaylıkla biliriz.
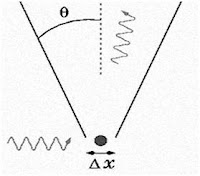
Ancak bu durum atomaltı dünyasında böyle değildir. Heisenberg elektron ve fotonları incelemiş ve davranışlarının bilardo topunun davranışlarından çok farklı olduğunu gözlemlemiştir. Herhangi bir maddeyi ve dolayısıyla elektronu gözleyebilmemiz için ona bir ışığın gitmesi ve bu ışığın oradan gözümüze gelmesi gerekir. Işık hem dalga hem de parçacık özelliğine sahiptir ve bu gözlem sırasında elektronun konumundaki belirsizliği azaltmak için kısa dalga boylu bir ışık kullanmamız lazımdır. Ama kısa dalga boyu yüksek bir enerji demektir ve bu, ışık elektrona çarptığında onun momentumunu ciddi bir şekilde etkileyecek ve parçacığın hızı hatalı ölçülmüş olacaktır.
Bunun daha iyi anlaşılması için somut bir örnek olarak deniz dalgalarını gösterebiliriz. Hareket halinde olan dalgayı bir nokta olarak belirtemezsiniz. Bazı yerlerde daha çok, diğer yerlerde daha az belirlidir.
Ölçüm Problemi
Heisenberg ayrıca bu atomaltı parçacıkların yerlerinin kesinlik kazanması durumunda, momentumlarının giderek daha belirsiz olduğunu bulmuştur. Momentumlarının belirli olduğu durumlarda ise yerleri belirsizlik kazanmaktadır.
Bu belirsizlik doğanın en önemli temel yasalarından, hatta yapı taşlarından biridir.
Örnek olarak en basit atom olan Hidrojene bakalım.
Hidrojende yalnız tek bir protondan oluşan çekirdeğin etrafındaki bir yörüngede tek bir elektron dönmektedir. Bu elektronun yeri az çok bilinmektedir. Ama buna rağmen hızını ve momentumunu bilmeye olanak yoktur. Çünkü tek olmasına rağmen elektron, aynı zamanda dalga da olduğu için, Hidrojen çekirdeğinin etrafında bir bulut oluşturmaktadır. Elektronun oluşturduğu bu bulutun bazı yerlerinde daha çok, diğer yerlerinde daha az zaman geçirdiğini söyleyebilirsiniz.
Tüm bunlar bizim, bir gözlemci olarak bir elektron hakkındaki bilgimizin sınırlı olduğu ve onunla ilgili bilgilerin tümüne erişemeyeceğimiz anlamına gelir. Atomaltı parçacıkları inceleyebilmek için bir foton gönderdiğimizde de fotonun etkisiyle sistem bozulacak, bundan böyle incelediğimiz sistem 'esas' sistem değil bizim etkimizle 'değişmiş' sistem olacaktır.
Yani Heisenberg'in yaptığı çalışmalara göre elektronların yerini ve momentumlarını diğer bir ifadeyle dalga mı parçacık mı olduğunu kesin olarak saptayamayız.
Meşhur Belirsizlik ilkesi formülleri. Bu formüller kısaca bir cismi gözlemlediğimizde kaçınılmaz olarak hep hatalı verilere sahip olacağımızı anlatır.
Ancak burada çok önemli bir detay vardır ve bazıları bu detayı geçiştirerek konuyu kapatmaya çalışır. Nitekim bu önemli detay, dünyada en yaygın okunan fizikçilerden olan John Gribbin tarafından şu şekilde belirtilmiştir:
 "Hiçbir varlık aynı anda tam belirlenmiş momentum ( bu esas itibari ile hız demektir) ve tam belirlenmiş pozisyona sahip değildir. Bu bizim ölçüm cihazımızın eksikliğinden kaynaklanan bir netice değildir. Bu sadece, örneğin bir elektronun, aynı anda hem konumunu hem momentumunu ölçemeyiz demek değildir. Bu bir elektronun aynı anda belli bir konum ve belli bir momentuma sahip olmaması demektir. Herhangi bir anda, elektronun kendisi nerede olduğunu ve nereye gittiğini bilemez. (Bazı referans kitapları hala kuantum belirsizliğinin yalnızca pozisyon ve momentumun aynı anda ölçmenin zorluğunun bir neticesidir diye anlatmaktadırlar; onlara inanmayın!)" ( Q is for Quantum Particle Physics From A to Z, John Gribbin, Sayfa 509 )
"Hiçbir varlık aynı anda tam belirlenmiş momentum ( bu esas itibari ile hız demektir) ve tam belirlenmiş pozisyona sahip değildir. Bu bizim ölçüm cihazımızın eksikliğinden kaynaklanan bir netice değildir. Bu sadece, örneğin bir elektronun, aynı anda hem konumunu hem momentumunu ölçemeyiz demek değildir. Bu bir elektronun aynı anda belli bir konum ve belli bir momentuma sahip olmaması demektir. Herhangi bir anda, elektronun kendisi nerede olduğunu ve nereye gittiğini bilemez. (Bazı referans kitapları hala kuantum belirsizliğinin yalnızca pozisyon ve momentumun aynı anda ölçmenin zorluğunun bir neticesidir diye anlatmaktadırlar; onlara inanmayın!)" ( Q is for Quantum Particle Physics From A to Z, John Gribbin, Sayfa 509 )


Düzgün bir anlatım. Tebrikler.
YanıtlaSil